La enfermedad inflamatoria intestinal (EII) es un término que define a una enfermedad crónica caracterizada por la inflamación del intestino1,2.
Aproximadamente el 50% de las pacientes con EII son diagnosticadas antes de los 35 años y el 25% de las pacientes concebirán tras el diagnóstico de la enfermedad, por lo que existe la preocupación sobre el efectos que pudieran tener tanto la enfermedad en sí como los medicamentos utilizados para tratarla en el desarrollo del embarazo y del recién nacido3-5.
Embarazo y EII.
No existe evidencia de que el embarazo empeore el curso de la enfermedad4. Así, las mujeres con EII tienen las mismas probabilidades de sufrir un brote de la enfermedad durante el embarazo que las que presentan antes de éste6-9.
Las mujeres con enfermedad quiescente al momento de la concepción y durante el embarazo tienen el mismo riesgo de presentar complicaciones del embarazo que la población general10. Tal vez presenten una mayor probabilidad de tener recién nacidos de bajo peso para la edad gestacional o prematuros, pero el riesgo es pequeño11, 12.
En cambio, la EII activa incrementa el riesgo de aborto espontáneo, de parto pretérmino (parto antes de las 37 semanas de gestación), de bajo peso al nacer (peso al nacer menor de 2.500 g) y de recién nacidos pequeños para la edad gestacional3, 11, 13-17. Por tanto, la actividad de la EII es el factor predictor más importante de la evolución del embarazo18. De esta forma, el control efectivo de la actividad de la enfermedad es de vital importancia durante la gestación.
Tratamiento de la EII durante el embarazo.
Dado que el mantenimiento de la remisión de la EII es primordial durante la gestación, el objetivo más importante antes y durante el embarazo de una paciente con EII es optimizar el control de su enfermedad mediante el tratamiento médico19, 20.
La mayoría de medicamentos utilizados para la EII no se asocian a efectos adversos importantes. Las tiopurinas y los anti-TNF, son fármacos ampliamente utilizados para inducir y mantener la remisión en pacientes con EII. Sin embargo, existe gran preocupación por parte de las pacientes y de los médicos que las atienden acerca del efecto de estos fármacos durante el embarazo, por lo que una correcta información acerca de los riesgos y beneficios de su utilización durante la gestación y de la importancia del control de la enfermedad es esencial para ayudarles a tomar una decisión sobre si continuar o no con la medicación21.
Tiopurinas.
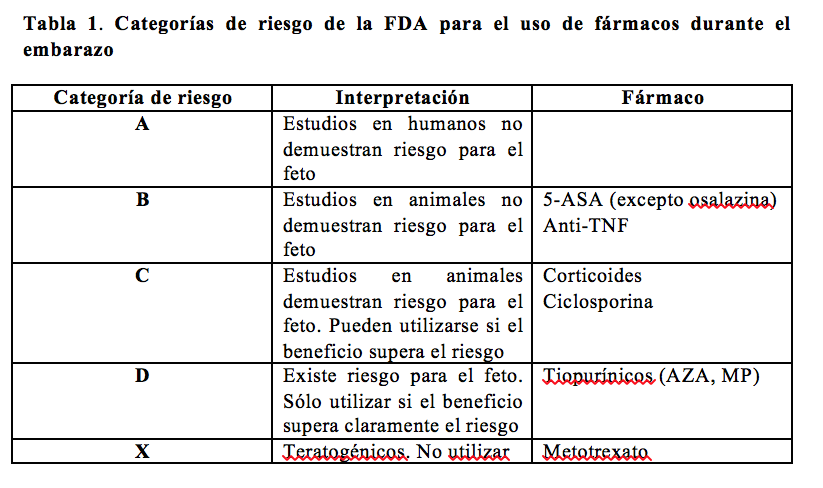
Las tiopurinas, que incluyen la azatioprina (AZA) y la 6-mercaptopurina (MP), son medicamentos utilizados para mantener la remisión de la EII y ambas pertenecen a la categoría D según la FDA (Tabla 1). En estudios en animales estos fármacos han demostrado ser teratogénicos22. No obstante, hasta cierto punto, la teratogenicidad de estos medicamentos puede tener relación con la dosis empleada, ya que en estudios realizados en ratones en los que se administraron tiopurinas a dosis equivalentes a las empleadas en humanos se observó una disminución de la fertilidad y bajo peso al nacer en las crías, pero no teratogenicidad19, 23-26.
En los seres humanos la AZA cruza la barrera placentaria. No obstante, el hígado fetal humano carece de la enzima iosinato-pirofosforilasa, la cual es necesaria para convertir a la AZA en MP. En teoría, este hecho protegería al feto de los efectos adversos de la AZA28-30.
La mayoría de datos publicados sugieren que las tiopurinas son seguras y bien toleradas durante el embarazo, aunque estos estudios tienen importantes limitaciones, como el hecho de tener un reducido tamaño de pacientes o no tener en consideración la actividad de la enfermedad16, 17, 31-33. En un estudio reciente, publicado por el grupo de investigación de la Unidad de Enfermedad Inflamatoria Intestinal del Hospital Universitario de La Princesa, en el que se tuvo en cuenta la actividad de la EII que presentaban las madres durante la gestación, se estudiaron 189 gestaciones cuyas madres estuvieron expuestas a tiopurinas durante el embarazo. En este estudio, se concluyó que las complicaciones del embarazo y del recién nacido fueron similares en el grupo expuesto a tiopurinas en comparación con el grupo no expuesto34.
Dado que tanto la AZA como la MP son fármacos eficaces para mantener la remisión de la EII, sobre todo en pacientes corticodependientes y corticorresistentes, y que no existen estudios concluyentes que demuestren un aumento en el riesgo de malformaciones congénitas, se debe considerar no suspender el tratamiento con estos fármacos durante el embarazo con el objetivo de mantener la remisión de la enfermedad27, 32, 35-38.
Fármacos anti-TNFα.
Los fármacos anti-TNF, que incluyen el infliximab (IFX), adalimumab (ADA) y certolizumab (CZB), se emplean para inducir y mantener la remisión de la EIIy los tres son considerados fármacos de categoría B según la FDA39-43.
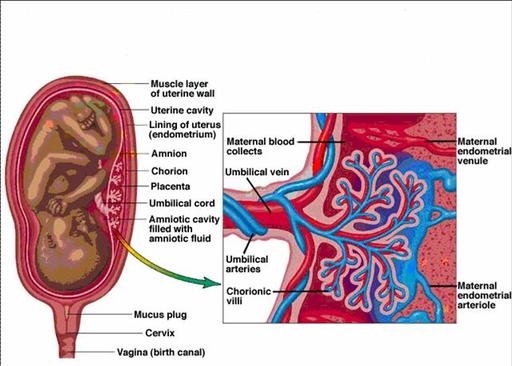
Las inmunoglobulinas G, como los anti-TNF, no atraviesan la barrera placentaria hasta el tercer trimestre del embarazo debido a que no pueden transportarse por difusión simple, ya que son moléculas de gran tamaño y, por tanto, requieren de un mecanismo de transporte activo a través de receptores específicos que se expresan en el sincitiotrofoblasto placentario durante el último trimestre del embarazo. Por este motivo, el feto se encuentra protegido del efecto de los anti-TNF durante los dos primeros trimestres de la gestación44. En consecuencia, sería recomendable suspender el tratamiento durante el tercer trimestre y reanudarlo después del parto si la enfermedad se encuentra en remisión, aunque esta recomendación no está claramente establecida45.
Infliximab.
El IFX fue el primer agente biológico aprobado por la FDA. En los escasos estudios que han incluido mujeres expuestas al IFX durante el embarazo no se han comunicado un mayor número de malformaciones congénitas o de parto pretérmino que en la población general34, 46. No obstante, se desconoce el efecto a largo plazo del IFX en el desarrollo del sistema inmune del niño19.
Adalimumab.
En los pocos casos publicados sobre el uso de ADA durante el embarazo, no se ha descrito morbilidad durante éste ni en el recién nacido47-49. Los pocos casos publicados sugieren que ADA, al igual que IFX, sería un fármaco de uso seguro durante el embarazo19.
Certolizumab.
CZB es un fragmento Fab del anticuerpo monoclonal TNFα. Al no ser una inmunoglobulina G1 (IgG1), se ha demostrado en modelos animales que no cruza la placenta a través de receptores fetales específicos, como ocurre con las IgG1 y los anti-TNF (IFX y ADA) y, por tanto, tendría la ventaja teórica de no tener que suspenderse durante el tercer trimestre del embarazo por temor a que atraviese la barrera feto-placentaria. En los pocos casos publicados en pacientes expuestas a CZB durante el embarazo, no se han descrito complicaciones34, 50.
Exposición fetal a tiopurinas.
Se ha descrito que la concentración placentaria de AZA es aproximadamente un 75% del nivel de dicho fármaco detectado en la sangre materna, mientras que en el cordón umbilical del feto, la concentración de AZA es de entre 1-5% del nivel detectado en la sangre materna51. De esta forma, la placenta parece comportarse como una importante barrera que impide el paso de tiopurinas al feto.
Aunque AZA cruza la placenta, la ausencia de la enzima involucrada en el metabolismo de las tiopurinas en el hígado fetal, que es inmaduro, parece proteger al feto de los potenciales efectos secundarios del fármaco, sobre todo en el crucial periodo de la organogénesis44, 52.
En líneas generales, si la EII de una paciente está bien controlada con tiopurinas, después de una discusión con la paciente y su pareja, parece razonable decidir continuar con el tratamiento durante el embarazo, especialmente si se tiene en cuenta que los pacientes con EII que suspenden las tiopurinas presentan un alto riesgo de recurrencia de la enfermedad y que la actividad de la EII podría tener efectos más deletéreos en el desarrollo del embarazo y del recién nacido que el potencial riesgo de continuar tomando estos fármacos153, 154. Además, es importante recordar que existen pocas alternativas a las tiopurinas para el control de la EII corticorresistente.
Efectos de las tiopurinas en los neonatos.

Angelberger y colaboradores.53 estudiaron a 15 recién nacidos expuestos a AZA durante el embarazo y la lactancia e hicieron un seguimiento de los niños durante una media de 3 años. A los niños se les administraron las vacunas correspondientes según el calendario de vacunación. Ningún niño presentó complicaciones relacionadas con las vacunas. Durante el seguimiento, solamente se encontró una mayor frecuencia de catarro común y de conjuntivitis en los niños expuestos a tiopurinas durante el embarazo y la lactancia en comparación con los no expuestos. No obstante, esta diferencia no fue estadísticamente significativa.
La seguridad de la administración de vacunas en los recién nacidos expuestos a tiopurinas durante el embarazo y la lactancia no es bien conocida. Existe la posibilidad de que estos niños presenten una respuesta inadecuada a las vacunas y puedan desarrollar enfermedades si son vacunados con virus vivos atenuados, riesgo que sería mayor si la vacunación ocurre durante el periodo de lactancia materna54. Se requieren más estudios en un mayor número de pacientes para determinar los efectos de los fármacos tiopurínicos en los niños expuestos a éstos durante la gestación y lactancia.
Exposición fetal a fármacos anti-TNF.
Tanto IFX como ADA son inmunoglobulinas de gran tamaño que requieren ser transportadas desde la sangre materna hacia el feto a través de la barrera placentaria. Este transporte está mediado por unos receptores fetales que se encuentran en la superficie placentaria. Estos receptores, aparecen en el feto en el segundo y, sobre todo, en el tercer trimestre del embarazo44.
Estos hallazgos sugieren que las pacientes embarazadas deberían evitar el tratamiento con fármacos anti-TNF después de la semana 30 de gestación con el fin de evitar la exposición fetal, aunque no se conoce si esta estrategia disminuye el riesgo de complicaciones futuras en los recién nacidos56-58.
Es importante señalar que la suspensión del tratamiento con fármacos anti-TNF se asocia a un alto riesgo de recurrencia de la enfermedad luminal (50%) y sobre todo perianal (70%), por lo que es importante sopesar el riesgo frente al beneficio de continuar con el tratamiento anti-TNF con la finalidad de evitar un brote de la EII59, 60. Incluso, si fuera necesario por la aparición de un brote de la EII, se ha sugerido que se puede plantear utilizar corticoides como tratamiento puente para controlar la actividad hasta el momento del parto56-58.
Efectos de los fármacos anti-TNFα en los neonatos.
No se han publicado datos acerca de la existencia de complicaciones en el recién nacido después de la exposición a fármacos anti-TNF en el tercer trimestre del embarazo, con la excepción de un caso de infección grave tras la vacunación del recién nacido con la vacuna BCG61.
Dado que IFX puede ser detectado en la sangre del recién nacido durante varios meses después del parto, se recomienda retrasar la vacunación del recién nacido con virus vivos atenuados al menos durante seis meses20, 62.
Conclusiones.
- A pesar de que AZA y MP son fármacos considerados categoría D por la FDA, los datos disponibles sugieren que estos fármacos son seguros y bien tolerados durante el embarazo.
- Los limitados datos clínicos disponibles, sugieren que la acción beneficiosa de los fármacos anti-TNF de inducir y mantener la remisión de la EII en pacientes embarazadas podría compensar el teórico riesgo de la exposición del feto a estos fármacos.
Referencias bibliográficas.
1. Carter MJ, Lobo AJ, Travis SP. Guidelines for the management of inflammatory bowel disease in adults. Gut 2004; 53 Suppl 5: V1-16.
2. Bernstein CN, Wajda A, Svenson LW, MacKenzie A, Koehoorn M, Jackson M, et al. The epidemiology of inflammatory bowel disease in Canada: a population-based study. Am J Gastroenterol 2006; 101: 1559-1568.
3. Elbaz G, Fich A, Levy A, Holcberg G, Sheiner E. Inflammatory bowel disease and preterm delivery. Int J Gynaecol Obstet 2005; 90: 193-197.
4. Ferguson CB, Mahsud-Dornan S, Patterson RN. Inflammatory bowel disease in pregnancy. BMJ 2008; 337: a427.
5. Andres PG, Friedman LS. Epidemiology and the natural course of inflammatory bowel disease. Gastroenterol Clin North Am 1999; 28: 255-281, vii.
6. Willoughby CP, Truelove SC. Ulcerative colitis and pregnancy. Gut 1980; 21: 469-474.
7. Nielsen OH, Andreasson B, Bondesen S, Jarnum S. Pregnancy in ulcerative colitis. Scand J Gastroenterol 1983; 18: 735-742.
8. Nielsen OH, Andreasson B, Bondesen S, Jacobsen O, Jarnum S. Pregnancy in Crohn’s disease. Scand J Gastroenterol 1984; 19: 724-732.
9. Miller JP. Inflammatory bowel disease in pregnancy: a review. J R Soc Med 1986; 79: 221-225.
10. Dubinsky M, Abraham B, Mahadevan U. Management of the pregnant IBD patient. Inflamm Bowel Dis 2008; 14: 1736-1750.
11. Mahadevan U, Sandborn WJ, Li DK, Hakimian S, Kane S, Corley DA. Pregnancy outcomes in women with inflammatory bowel disease: a large community-based study from Northern California. Gastroenterology 2007; 133: 1106-1112.
12. Dominitz JA, Young JC, Boyko EJ. Outcomes of infants born to mothers with inflammatory bowel disease: a population-based cohort study. Am J Gastroenterol 2002; 97: 641-648.
13. Norgard B, Pedersen L, Christensen LA, Sorensen HT. Therapeutic drug use in women with Crohn’s disease and birth outcomes: a Danish nationwide cohort study. Am J Gastroenterol 2007; 102: 1406-1413.
14. Kornfeld D, Cnattingius S, Ekbom A. Pregnancy outcomes in women with inflammatory bowel disease–a population-based cohort study. Am J Obstet Gynecol 1997; 177: 942-946.
15. Fonager K, Sorensen HT, Olsen J, Dahlerup JF, Rasmussen SN. Pregnancy outcome for women with Crohn’s disease: a follow-up study based on linkage between national registries. Am J Gastroenterol 1998; 93: 2426-2430.
16. Moser MA, Okun NB, Mayes DC, Bailey RJ. Crohn’s disease, pregnancy, and birth weight. Am J Gastroenterol 2000; 95: 1021-1026.
17. Norgard B, Fonager K, Sorensen HT, Olsen J. Birth outcomes of women with ulcerative colitis: a nationwide Danish cohort study. Am J Gastroenterol 2000; 95: 3165-3170.
18. Katz JA, Pore G. Inflammatory bowel disease and pregnancy. Inflamm Bowel Dis 2001; 7: 146-157.
19. Gisbert JP. Safety of immunomodulators and biologics for the treatment of inflammatory bowel disease during pregnancy and breast-feeding. Inflamm Bowel Dis 2010; 16: 881-895.
20. van der Woude CJ, Kolacek S, Dotan I, Oresland T, Vermeire S, Munkholm P, et al. European evidenced-based consensus on reproduction in inflammatory bowel disease. J Crohns Colitis 2010; 4: 493-510.
21. Mahadevan U. Fertility and pregnancy in the patient with inflammatory bowel disease. Gut 2006; 55: 1198-1206.
22. Polifka JE, Friedman JM. Teratogen update: azathioprine and 6-mercaptopurine. Teratology 2002; 65: 240-261.
23. Voogd CE. Azathioprine, a genotoxic agent to be considered non-genotoxic in man. Mutat Res 1989; 221: 133-152.
24. Mosesso P, Palitti F. The genetic toxicology of 6-mercaptopurine. Mutat Res 1993; 296: 279-294.
25. Platzek T, Bochert G. Dose-response relationship of teratogenicity and prenatal-toxic risk estimation of 6-mercaptopurine riboside in mice. Teratog Carcinog Mutagen 1996; 16: 169-181.
26. Bermas BL, Hill JA. Effects of immunosuppressive drugs during pregnancy. Arthritis Rheum 1995; 38: 1722-1732.
27. Alstead EM, Ritchie JK, Lennard-Jones JE, Farthing MJ, Clark ML. Safety of azathioprine in pregnancy in inflammatory bowel disease. Gastroenterology 1990; 99: 443-446.
28. Connell W, Miller A. Treating inflammatory bowel disease during pregnancy: risks and safety of drug therapy. Drug Saf 1999; 21: 311-323.
29. Hou S. Pregnancy in renal transplant recipients. Adv Ren Replace Ther 2003; 10: 40-47.
30. Mahadevan U, Kane S. American gastroenterological association institute technical review on the use of gastrointestinal medications in pregnancy. Gastroenterology 2006; 131: 283-311.
31. Coelho J, Beaugerie L, Colombel JF, Hebuterne X, Lerebours E, Lemann M, et al. Pregnancy outcome in patients with inflammatory bowel disease treated with thiopurines: cohort from the CESAME Study. Gut 2011; 60: 198-203.
32. Francella A, Dyan A, Bodian C, Rubin P, Chapman M, Present DH. The safety of 6-mercaptopurine for childbearing patients with inflammatory bowel disease: a retrospective cohort study. Gastroenterology 2003; 124: 9-17.
33. Moskovitz DN, Bodian C, Chapman ML, Marion JF, Rubin PH, Scherl E, et al. The effect on the fetus of medications used to treat pregnant inflammatory bowel-disease patients. Am J Gastroenterol 2004; 99: 656-661.
34. Casanova MJ, Chaparro M, Domenech E, Barreiro-de Acosta M, Bermejo F, Iglesias E, et al. Safety of Thiopurines and Anti-TNF-alpha Drugs During Pregnancy in Patients With Inflammatory Bowel Disease. Am J Gastroenterol 2013.
35. Alstead E. Fertility and pregnancy in inflammatory bowel disease. World J Gastroenterol 2001; 7: 455-459.
36. Alstead EM. Inflammatory bowel disease in pregnancy. Postgrad Med J 2002; 78: 23-26.
37. Alstead EM, Nelson-Piercy C. Inflammatory bowel disease in pregnancy. Gut 2003; 52: 159-161.
38. Lamah M, Scott HJ. Inflammatory bowel disease and pregnancy. Int J Colorectal Dis 2002; 17: 216-222.
39. Administration FaD. Regulations 1980; 44: 37434-37467.
40. Hanauer SB, Feagan BG, Lichtenstein GR, Mayer LF, Schreiber S, Colombel JF, et al. Maintenance infliximab for Crohn’s disease: the ACCENT I randomised trial. Lancet 2002; 359: 1541-1549.
41. Sandborn WJ, Feagan BG, Stoinov S, Honiball PJ, Rutgeerts P, Mason D, et al. Certolizumab pegol for the treatment of Crohn’s disease. N Engl J Med 2007; 357: 228-238.
42. Schreiber S, Khaliq-Kareemi M, Lawrance IC, Thomsen OO, Hanauer SB, McColm J, et al. Maintenance therapy with certolizumab pegol for Crohn’s disease. N Engl J Med 2007; 357: 239-250.
43. Colombel JF. Efficacy and safety of adalimumab for the treatment of Crohn’s disease in adults. Expert Rev Gastroenterol Hepatol 2008; 2: 163-176.
44. Chaparro M, Gisbert JP. Transplacental transfer of immunosuppressants and biologics used for the treatment of inflammatory bowel disease. Curr Pharm Biotechnol 2011; 12: 765-773.
45. Rutgeerts P, Van Assche G, Vermeire S. Review article: Infliximab therapy for inflammatory bowel disease–seven years on. Aliment Pharmacol Ther 2006; 23: 451-463.
46. O’Donnell S, O’Morain C. Review article: use of antitumour necrosis factor therapy in inflammatory bowel disease during pregnancy and conception. Aliment Pharmacol Ther 2008; 27: 885-894.
47. Vesga L, Terdiman JP, Mahadevan U. Adalimumab use in pregnancy. Gut 2005; 54: 890.
48. Carter JD, Ladhani A, Ricca LR, Valeriano J, Vasey FB. A safety assessment of tumor necrosis factor antagonists during pregnancy: a review of the Food and Drug Administration database. J Rheumatol 2009; 36: 635-641.
49. Mishkin DS, Van Deinse W, Becker JM, Farraye FA. Successful use of adalimumab (Humira) for Crohn’s disease in pregnancy. Inflamm Bowel Dis 2006; 12: 827-828.
50. Oussalah A, Bigard MA, Peyrin-Biroulet L. Certolizumab use in pregnancy. Gut 2009; 58: 608.
51. Saarikoski S, Seppala M. Immunosuppression during pregnancy: transmission of azathioprine and its metabolites from the mother to the fetus. Am J Obstet Gynecol 1973; 115: 1100-1106.
52. Saha S, Wald A. Safety and efficacy of immunomodulators and biologics during pregnancy and lactation for the treatment of inflammatory bowel disease. Expert Opin Drug Saf 2012; 11: 947-957.
53. Angelberger S, Reinisch W, Messerschmidt A, Miehsler W, Novacek G, Vogelsang H, et al. Long-term follow-up of babies exposed to azathioprine in utero and via breastfeeding. J Crohns Colitis 2011; 5: 95-100.
54. Biedermann L, Rogler G, Vavricka SR, Seibold F, Seirafi M. Pregnancy and breastfeeding in inflammatory bowel disease. Digestion 2012; 86 Suppl 1: 45-54.
55. Roopenian DC, Akilesh S. FcRn: the neonatal Fc receptor comes of age. Nat Rev Immunol 2007; 7: 715-725.
56. Vasiliauskas EA, Church JA, Silverman N, Barry M, Targan SR, Dubinsky MC. Case report: evidence for transplacental transfer of maternally administered infliximab to the newborn. Clin Gastroenterol Hepatol 2006; 4: 1255-1258.
57. Friedman S, Regueiro MD. Pregnancy and nursing in inflammatory bowel disease. Gastroenterol Clin North Am 2002; 31: 265-273, xii.
58. Hou JK, Mahadevan U. A 24-year-old pregnant woman with inflammatory bowel disease. Clin Gastroenterol Hepatol 2009; 7: 944-947.
59. Louis E, Mary JY, Vernier-Massouille G, Grimaud JC, Bouhnik Y, Laharie D, et al. Maintenance of remission among patients with Crohn’s disease on antimetabolite therapy after infliximab therapy is stopped. Gastroenterology 2012; 142: 63-70 e65; quiz e31.
60. Domenech E, Hinojosa J, Nos P, Garcia-Planella E, Cabre E, Bernal I, et al. Clinical evolution of luminal and perianal Crohn’s disease after inducing remission with infliximab: how long should patients be treated? Aliment Pharmacol Ther 2005; 22: 1107-1113.
61. Cheent K, Nolan J, Shariq S, Kiho L, Pal A, Arnold J. Case Report: Fatal case of disseminated BCG infection in an infant born to a mother taking infliximab for Crohn’s disease. J Crohns Colitis 2010; 4: 603-605.
62. Zelinkova Z, van der Ent C, Bruin KF, van Baalen O, Vermeulen HG, Smalbraak HJ, et al. Effects of Discontinuing Anti-Tumor Necrosis Factor Therapy During Pregnancy on the Course of Inflammatory Bowel Disease and Neonatal Exposure. Clin Gastroenterol Hepatol 2012.