Dentro de este grupo, se incluyen dos enfermedades con diferentes características clínicas y evolución: colitis ulcerosa y enfermedad de Crohn, y una tercera, que comparte características de ambas: la enfermedad inflamatoria intestinal no clasificada o colitis indeterminada.
Colitis ulcerosa (CU). Enfermedad inflamatoria intestinal crónica que afecta de forma muy difusa y continua exclusivamente a la mucosa de colon.
Enfermedad de Crohn (EC). Enfermedad inflamatoria intestinal crónica que puede afectar a todo el tubo digestivo, desde la boca hasta el ano, de forma segmentaria, siendo su característica histológica la afectación transmural de la mucosa y la presencia de granulomas no caseificantes.
Enfermedad inflamatoria intestinal no clasificada o colitis indeterminada (EII-nc). Enfermedad inflamatoria intestinal crónica que afecta exclusivamente a colon y cuyas características clínicas, endoscópicas e histológicas no permiten su inclusión en las dos entidades anteriores(1,2).
Epidemiología
El registro pediátrico español refiere un aumento de incidencia en los últimos veinticinco años de 2,51 casos por 100.000 habitantes y año, en pacientes menores de 18 años hasta el año 2010(3).
La CU ha sufrido menor aumento de incidencia que la EC, estando en relación el incremento de esta última, a la mayor incidencia de casos pediátricos. Se calcula que aproximadamente un 30% de los casos de EII aparecen antes de los 20 años de edad, aunque los menores de 5 años suponen menos de un 5% del total de casos. La prevalencia global se estima en 0,4%(1,2).
La EII predomina en países industrializados y áreas urbanas, siendo más frecuente en raza caucásica y especialmente en judíos.
Etiopatogenia
La posibilidad de desarrollar EII cuando uno de los padres está afectado es del 9,2% para la EC y del 6,2% para la CU. Cuando padre y madre padecen EII, el riesgo de padecerla los hijos aumenta hasta el 30%. Asimismo, la concordancia en padecer la enfermedad en gemelos apoya la base genética de la misma.
Distintos genes se han asociado con EII. El gen que codifica NOD2, situado en el cromosoma 16, renombrado como CARD15 a partir de la publicación del genoma humano, se ha asociado con EC de inicio temprano y con EC estenosante. La explicación de este hecho está en la función deCARD15 en el reconocimiento bacteriano, la apoptosis y la señalización inflamatoria.
Otros factores genéticos, sin influir en la susceptibilidad pueden, sin embargo, condicionar el curso de la misma, como: la presencia de HLA DR2 asociado con colitis ulcerosa en japoneses; el HLA-DR3-DQ2 con pancolitis ulcerosa; o el HLA-DRB*0103* con presencia de manifestaciones extraintestinales y con la necesidad de cirugía en la EC.
Existe, por tanto, una disregulación genéticamente determinada de la respuesta inmune frente a la flora bacteriana, que da lugar a la activación de linfocitos T-CD4 y que produce una inflamación intestinal incontrolada que se autoperpetúa por aumento de mediadores proinflamatorios La respuesta inmune es diferente en ambas entidades, estando en el caso de EC mediada por Th1 y en la CU por anticuerpos.
Distintos factores ambientales se han relacionado con la EII, entre ellos: la lactancia materna como protector para el desarrollo de la misma, el tipo de dieta, el tabaco y la apendicetomía previa (protectores para CU y de riesgo para EC)(2).
Clínica
Existen diferentes subgrupos evolutivos de EII:
• Aguda fulminante, que se da en el 5% de las CU como forma de inicio.
• Crónica intermitente: con periodos de actividad-remisión.
• Crónica continua: refractaria al tratamiento después de 6 m, con mejoría parcial o remisiones cortas.
Colitis ulcerosa
Las formas clínicas varían según la gravedad y la extensión de la presentación.
Dependiendo de la extensión de la enfermedad y según la clasificación de París del año 2009, denominamos como:
• Rectitis o proctitis (E1): cuando solamente está afecto el recto.
• Colitis izquierda (E2): cuando la afectación llega al ángulo esplénico.
• Colitis extensa (E3): cuando se afecta el colon transverso.
• Pancolitis (E4): si la afectación incluye ciego.
A esta nomenclatura, se añaden los subtipos:
• S0: nunca evolución grave.
• S1: grave a lo largo de la evolución.
En los niños, la proctitis aislada es menos frecuente que en adultos, siendo más frecuentes la colitis extensa y la pancolitis, que ocurre sobre todo, en pacientes menores de 5 años. En casos leves, no existe repercusión sobre el estado general, ni analítica, pero, al menos, un 10% de casos pediátricos corresponden a formas graves de la enfermedad.
Enfermedad de Crohn
Solamente un 25% de los pacientes presenta la tríada clásica de: dolor abdominal, pérdida de peso y diarrea.
La EC puede afectar a cualquier zona del tracto digestivo, desde la boca hasta el ano, pudiendo complicarse su evolución por la aparición de fístulas y abscesos intraabdominales y por posibles estenosis, que obligan a tratamientos quirúrgicos repetidos en estos pacientes.
Las formas más precoces se asocian con formas más graves y extensas de la enfermedad.
En pacientes pediátricos, la existencia de dolor epigástrico, náuseas, vómitos y anorexia, son factores predictivos de afectación del tracto digestivo superior.
En aquellos casos con síntomas poco evidentes de EII, un examen físico cuidadoso puede poner en evidencia: palidez muco-cutánea, como resultado de la anemia, presencia de masas abdominales o un deficiente estado nutricional que pueden orientar al diagnóstico. Por otra parte, ante el hallazgo de lesiones perianales, es obligado descartar EC(4-6).
Los síntomas más frecuentes en ambas enfermedades quedan recogidos en la tabla I.
La clasificación de EC según los criterios de Montreal(7), modificada en los criterios de Porto de 2012(5), queda reflejada en la tabla II.
Manifestaciones extradigestivas
Las manifestaciones extradigestivas son múltiples y pueden preceder o coincidir en el tiempo con el debut de la enfermedad. Pueden aparecer en, al menos, un 30% de los casos. Las más frecuentes son las osteoarticulares, seguidas de las cutáneas, orales y oculares. En general, la actividad sigue el mismo curso que la inflamación intestinal, pero algunas como la colangitis esclerosante, pueden seguir un curso independiente de la misma.
Las manifestaciones extraintestinales más frecuentes quedan referidas en la tabla III.
Una consideración especial requiere la aparición de osteoporosis como complicación extradigestiva de la EII. Su prevalencia es variable, entre 8 y 40%, según las distintas series. Es más frecuente en pacientes con EC que en CU, sobre todo, en aquellos con retraso de crecimiento, malnutrición o toma prolongada de corticosteroides. La realización de densitometrías seriadas y el tratamiento con vitamina D y calcio, junto con un adecuado soporte nutricional y el empleo de terapias alternativas a los corticoides, es imprescindible para prevenir la aparición de fracturas en la vida adulta(8,9).
Fallo de crecimiento
Los casos de EC con afectación de intestino delgado están más frecuentemente afectos que los casos de afectación colónica exclusiva o en la CU. Aun con el tratamiento nutricional adecuado, un 15% de pacientes no recuperan la talla de forma definitiva(10,11).
Diagnóstico
Laboratorio
La ferritina es un reactante de fase aguda, por lo que la anemia ferropénica no se acompaña de ferritina baja. La calprotectina fecal, como proteína de degradación de polimorfonucleares, es el marcador más sensible de inflamación intestinal y su elevación es discriminativa en el diagnóstico de brote agudo de la enfermedad(4).
La determinación de p-ANCA (anticuerpo anticitoplasma perinuclear de los neutrófilos) y ASCA (anticuerpo anti- Sacharomyces cerevesiae) puede ser útil en caso de diagnóstico dudoso, p-ANCA es positivo en 50-60% de CU y 5-10% en EC, ASCA en 50-80% de EC y 10% de CU. Su negatividad no excluye la enfermedad(4-6,11).
Endoscopia
Es aconsejable, en esta primera evaluación, realizar también endoscopia digestiva alta, que es obligada en los siguientes casos(14):
• Evaluación inicial de paciente con EC.
• Pacientes con EII-nc.
• Sospecha de otras enfermedades asociadas: enfermedad celíaca, enfermedades linfoproliferativas, gastritis autoinmune o infecciosa, etc.
• Pacientes con CU y clínica digestiva alta.
La afectación del colon es común a la CU y a la EC, aunque las características endoscópicas e histológicas son totalmente distintas en ambos casos.
La valoración endoscópica inicial es imprescindible antes de iniciar el tratamiento, ya que este puede modificar las características macroscópicas de ambas enfermedades.
La exploración previa de la región anal y perianal es obligada, ya que la presencia de lesiones en esa zona indica la existencia de EC.
A lo largo de su vida, los pacientes pediátricos con EII precisarán múltiples endoscopias altas y colonoscopias, por lo que la realización de estas debe restringirse a las situaciones en las que, ante un posible brote de la enfermedad, se sospeche un cambio en la localización o extensión o interese documentar la curación mucosa después de un tratamiento.
La endoscopia puede diferenciar la CU de la EC aproximadamente en el 80-90% de los casos.
Cuando esto no es posible, la histología no es patognomónica y existe afectación exclusiva del colon, se establece el diagnóstico de enfermedad inflamatoria intestinal no clasificada (EII-nc), entidad que comparte características comunes a ambas enfermedades y que es más frecuente en niños pequeños, en los que evolutivamente el proceso se decantará en uno u otro sentido(13,14).
Características endoscópicas de la colitis ulcerosa
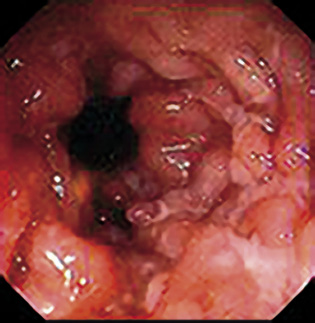
La CU se caracteriza por los siguientes datos endoscópicos (Fig. 1):
Figura 1. Colitis ulcerosa con úlceras profundas en sacabocados.
• Afectación continua desde el recto hasta ciego con mayor intensidad distal.
• Afectación de toda la circunferencia del colon.
• Granularidad, friabilidad y pérdida del patrón vascular.
• Erosiones y úlceras puntiformes que pueden confluir dando lugar a ulceraciones grandes profundas en sacabocados, en la mayoría de los casos recubiertas de fibrina.
Dependiendo de la extensión de la enfermedad hablamos de:
• Rectitis o proctitis: cuando solamente está afecto el recto.
• Rectosigmoiditis: afectación de recto y sigma.
• Colitis izquierda: cuando la afectación llega a ángulo esplénico.
• Colitis extensa: cuando se afecta colon transverso.
• Pancolitis: si la afectación incluye ciego.
El examen histológico demuestra: distorsión de la arquitectura de las criptas, depleción de mucina y abscesos crípticos, todo ello limitado a la mucosa.
Características endoscópicas de la enfermedad de Crohn
A diferencia de la CU, los hallazgos endoscópicos en la EC son los siguientes (Fig. 2):
Figura 2. Enfermedad de Crohn con pseudopólipos y estenosis en ciego.
• Afectación discontinua y segmentaria.
• Aspecto en empedrado.
• Vascularización conservada.
• Úlceras aftoides, serpiginosas o en sacabocados.
• Fístulas.
• Afectación de íleon terminal y válvula ileocecal.
Según la localización:
• Ileítis.
• Ileocolitis.
• Colitis.
• Yeyuno-ileítis difusa.
• Afectación esofagogastroduodenal.
• Afectación perianal pura.
La histología en la EC demuestra inflamación transmural y la presencia de granulomas epiteliodes, presentes en menos del 50% de las biopsias, pero que cuando se encuentran son patognomónicos de la enfermedad.
La única contraindicación absoluta de colonoscopia es la presencia de megacolon tóxico. En este caso, se debe esperar a su resolución para realizar la exploración, ya que nunca es tan urgente diferenciar entre colitis ulcerosa o colitis de Crohn, como para arriesgar al paciente a una posible perforación del colon. La exploración debe realizarse con precaución si existe un brote grave de la enfermedad o si existen úlceras profundas o estenosis(13).
Pruebas de imagen
Precisa la colaboración del niño, que debe ingerir un alto volumen de líquido, lo que impide realizar su prueba bajo anestesia e imposibilita la realización en niños pequeños. En los casos en que la prueba no pueda realizarse o no se disponga de esta posibilidad diagnóstica en el centro, puede recurrirse a la práctica de capsuloendoscopia.
La resonancia magnética de la región pélvica es imprescindible en aquellos casos de EC con afectación perianal o en aquellos en que exista sospecha de enfermedad fistulizante.
El algoritmo diagnóstico cuando exista sospecha de EII, queda reflejado en la figura 3.
Figura 3. Evaluación del niño/adolescente con síntomas digestivos o extradigestivos sugestivos de enfermedad inflamatoria intestinal (EII). Tomado de: ESPGHAN revised Porto criteria for diagnosis of IBD. JPGN. 2014. CU: colitis ulcerosa; EC: enfermedad de Crohn; ERM?: considerar enteroresonancia magnética (enteroRM); EII-I: EII-indeterminada.
Tratamiento
La creación de equipos multidisciplinarios que atiendan a estos pacientes en el contexto de Unidades de Cuidado Integral de EII es fundamental para el manejo clínico de los aspectos médicos, quirúrgicos, nutricionales y psicosociales que la enfermedad conlleva.
Aminosalicilatos
La sulfasalazina ha sido sustituida en los últimos años por compuestos derivados del 5-aminosalicílico (5ASA), debido a sus innumerables efectos secundarios. La mesalazina puede utilizarse como tratamiento inicial de la EII, en brote leve a moderado. Los 5ASA están indicados en presencia de enfermedad cólica, aunque existen preparaciones en gránulos con cubierta entérica que son eficaces en íleon distal. Su utilización en CU, a largo plazo, puede prevenir la aparición de cáncer, pero su eficacia en el mantenimiento a largo plazo en EC es escasa. La dosis es de 30-50 mg por kilogramo de peso y día, repartida en 2-3 tomas.
Existen preparados en supositorios y enemas, útiles en tratamiento de colitis distal.
Corticoides
Se puede utilizar prednisona o 6-metil prednisolona por vía oral o intravenosa, respectivamente, o budesonida, disponible en cápsulas y enemas para tratamiento local.
Los corticoides son eficaces en inducir la remisión en EII en un porcentaje elevado de pacientes, pero los importantes efectos secundarios que conllevan los hacen desaconsejables como terapia de mantenimiento.
La dosis es de 1-1,5 mg/kg/día durante 4-6 semanas, con descenso progresivo escalonado a razón de 5 mg a la semana.
Antibióticos
Los antibióticos pueden ser útiles en determinadas formas de EII, modulando la respuesta inmune a las bacterias intestinales causantes de la inflamación.
En casos graves, deben usarse antibióticos de amplio espectro como preventivos de sepsis con puerta de entrada intestinal.
En la EC perianal o fistulizante y en casos de reservoritis, estaría indicado utilizar metronidazol a 15-20 mg/kg/día o ciprofloxacino a 20 mg/kg/día. La rifaximina es una alternativa terapéutica en estos casos.
Inmunomoduladores
La azatioprina y la 6-mercaptopurina son los inmunomoduladores más utilizados en el mantenimiento de la remisión, tanto de EC como de CU. Los niveles terapéuticos se alcanzan a las 8-12 semanas del inicio de tratamiento. La dosis efectiva está entre 2-3 mg/kg de peso. La instauración precoz de tratamiento con azatioprina se asocia con mejor evolución a largo plazo de la enfermedad y con una tasa menor de recurrencia. En el momento actual, se recomienda iniciar tratamiento con azatioprina en el primer brote de EC junto con terapia nutricional, manteniendo el inmunomodulador hasta, al menos, 2 años después del último episodio de actividad y, al menos, hasta después de finalizado el crecimiento.
Entre los efectos adversos, precoces que ocurren en los primeros días o semanas del tratamiento, pueden presentarse: náuseas, vómitos, temblores, dolor muscular, aparición de pancreatitis y hepatitis tóxica; por lo que en las primeras semanas, hay que controlar con hemograma, determinación de enzimas hepáticos y pancreáticos. Pueden darse efectos adversos tardíos, fundamentalmente pancitopenia e infecciones oportunistas.
Cuando la azatioprina es mal tolerada, puede recurrirse a inmunomoduladores de segunda línea: metrotexate, ciclosporina o tacrolimus, o bien iniciar tratamiento con fármacos biológicos anti-TNF.
Anticuerpos anti factor de necrosis tumoral (anti-TNF)
En el momento actual, tanto el infliximab (IFX), que es un anticuerpo monoclonal quimérico humano (75%) y murino (25%), como el adalimumab (ADA) (100% humano), tienen indicación para el tratamiento de la EC pediátrica y autorizados para la terapia de CU en adultos, pudiendo utilizarse en niños, en casos de CU grave o refractaria. La objetivación de que la respuesta es mejor en aquellos casos en que el tratamiento se instaura en los dos primeros años, tras el debut clínico y en pacientes jóvenes, ha conducido aINVERTIR EN algunos casos la estrategia terapéutica, pudiendo indicarse como tratamiento inicial en: EC extensa, fistulizante o perianal y en aquellos casos que se acompañan de manifestaciones extradigestivas(15,16).
algunos casos la estrategia terapéutica, pudiendo indicarse como tratamiento inicial en: EC extensa, fistulizante o perianal y en aquellos casos que se acompañan de manifestaciones extradigestivas(15,16).
 algunos casos la estrategia terapéutica, pudiendo indicarse como tratamiento inicial en: EC extensa, fistulizante o perianal y en aquellos casos que se acompañan de manifestaciones extradigestivas(15,16).
algunos casos la estrategia terapéutica, pudiendo indicarse como tratamiento inicial en: EC extensa, fistulizante o perianal y en aquellos casos que se acompañan de manifestaciones extradigestivas(15,16).
La dosis de infliximab es de 5 mg/kg intravenoso, hasta un máximo de 300 mg, con 3 dosis iniciales en el intervalo de 6 semanas y, posteriormente, una administración cada 8 semanas como mantenimiento. Cuando existe pérdida de respuesta, es posible aumentar la dosis hasta 10 mg/kg o acortar el intervalo entre dosis.
El adalimumab se administra en dosis quincenales de 20 mg subcutáneos, con una dosis de inducción de hasta 80 mg la primera semana, en relación al peso del niño.
La pérdida de respuesta junto con la posible aparición de reacciones infusionales y de hipersensibilidad tardías se relaciona con la posible formación de anticuerpos anti-TNF.
Entre los efectos adversos están la aparición de: infecciones oportunistas (tuberculosis, neumonías, herpes zóster), enfermedades desmielinizantes, neuritis óptica, convulsiones y enfermedades autoinmunes (1%).
Se ha relacionado la azatioprina con la aparición de linfoma hepatoesplénico, por lo que se recomienda suspender esta cuando el estado del paciente lo permita.
Tratamiento nutricional
La terapia nutricional cumple una doble función: por una parte, de soporte nutricional, corrigiendo las deficiencias de micro y macronutrientes y aportando las proteínas y calorías necesarias para la recuperación del estado nutricional; y, por otra parte, terapéutica. En la CU, la nutrición actúa exclusivamente como soporte; sin embargo, en la EC constituye una importante alternativa al tratamiento con corticoides. Diversos trabajos en EC pediátrica han demostrado que la terapia nutricional es tan eficaz como los corticoides para inducir la remisión, careciendo de los efectos adversos sobre el crecimiento de estos(17).
Los mejores resultados de la nutrición enteral exclusiva se dan en pacientes de nuevo diagnóstico con afectación ileal, con peor respuesta en la EC gastroduodenal, perianal o con manifestaciones extradigestivas. La utilización de dieta polimérica modificada con adición de TGF-beta (transforming growth factor beta), parece ser más eficaz que la dieta polimérica convencional en la disminución de losÍNDICES DE ACTIVIDAD clínicos y de IL-1B (interleuquina 1B), IL-8 (interleuquina 8) e interferón gamma, en mucosa intestinal(18).
clínicos y de IL-1B (interleuquina 1B), IL-8 (interleuquina 8) e interferón gamma, en mucosa intestinal(18).
 clínicos y de IL-1B (interleuquina 1B), IL-8 (interleuquina 8) e interferón gamma, en mucosa intestinal(18).
clínicos y de IL-1B (interleuquina 1B), IL-8 (interleuquina 8) e interferón gamma, en mucosa intestinal(18).
El protocolo terapéutico en EC de nuevo diagnóstico se recoge en el algoritmo al final del artículo.
Leucocitoaféresis
La leucocitoaferesis es una novedosa técnica que consiste en el filtrado de sangre a través de un sistema de micropartículas de acetato de celulosa, con lo que se consigue la adsorción de leucocitos circulantes activados, induciendo cambios funcionales en estas células que dan lugar a la disminución de citoquinas proinflamatorias, con lo que se consigue un efecto inmunomodulador sobre la enfermedad. Ha sido utilizada con buenos resultados en pacientes adultos y pediátricos con CU corticodependiente y corticorresistente, en CU de nuevo diagnóstico y puede ser una buena alternativa terapéutica en el mantenimiento de la remisión de CU(19).
Cirugía
En la CU grave refractaria a tratamiento médico, la colectomía con reservorio íleo-anal es curativa.
Los pacientes con EC pueden precisar cirugía a lo largo de su vida, sobre todo, para el tratamiento de fístulas y abscesos, y en casos de cuadros obstructivos por estenosis, fundamentalmente de íleon terminal. El tratamiento quirúrgico, en este último caso, mantiene la remisión durante periodos prolongados.
Bibliografía
1. Kugathasan S. Amre D. Inflammatory bowel disease – environmental modification and genetic determinants. Pediatr Clin North Am. 2006; 53(4): 727-749.
2. Beattie RM, Croft NM, Fell JM, Afzal NA, Heuschkel RB. Inflammatory bowel disease. Arch Dis Child. 2006; 91: 426-32.
3. Martín de Carpi J, Rodríguez A, Ramos E, Jiménez S, Martínez-Gómez MJ, Medina E; SPIRIT-IBD Working Group of Sociedad Española de Gastroenterología, Hepatología y Nutricion Pediátrica. Increasing incidence of pediatric inflammatory bowel disease in Spain (1996-2009): the SPIRIT Registry. Inflamm Bowel Dis. 2013; 19(1): 73-80.
4. IBD Working Group of the European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) Inflammatory Bowel Disease in Children and Adolescents: Recommendations for Diagnosis. The Porto Criteria. J Pediatr Gastroenterol Nutr. 2005; 41: 1-7.
5. IBD Working Group of the European Society for Paediatric Gastroenterology Hepatology and Nutrition. Inflammatory bowel disease in children and adolescents: recommendations for diagnosis – the Porto criteria. J Pediatr Gastroenterol Nutr. 2014; 58: 6: 795-806.
6. Working Group of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition and the Crohn’s and Colitis Foundation of America. Differentiating Ulcerative Colitis from Crohn Disease in Children and Young Adults. J Pediatr Gastroenterol Nutr. 2007; 44: 653-74.
7. Silverberg MS, Satsangi J, Ahmad T, Arnott ID, Bernstein CN, Brant SR et al. Toward and integrated clinical, molecular and serological classification of inflammatory bowel disease. Report of a working party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol. 2005; 19(supl A): 5-36.
8. Dotson JL, Hyams JS, Markowitz J, et al. Extraintestinal manifestations of pediatric inflammatory bowel disease and their relation to disease type and severity. J Pediatr Gastroenterol Nutr. 2010; 51: 140-45.
9. Jose FA, Herman MB. Extraintestinal manifestations of inflammatory bowel disease. J Pediatr Gastroenterol Nutr. 2008; 46: 124-33.
10. Silvester FA. IBD and skeletalHEALTH : children are not small adults. Inflamm Bowel Dis. 2005; 11: 1020-23.
: children are not small adults. Inflamm Bowel Dis. 2005; 11: 1020-23.
 : children are not small adults. Inflamm Bowel Dis. 2005; 11: 1020-23.
: children are not small adults. Inflamm Bowel Dis. 2005; 11: 1020-23.
11. Dubinsky M. Special issues in pediatric inflammatory bowel disease. World J Gastroenterol. 2008; 14: 413-20.
12. Vucelic B. Inflammatory bowel disease: Controversies in the use of diagnostic procedures. Dig Dis.2009; 27: 269-77.
13. Martínez Gómez MJ. Colonoscopia en la enfermedad inflamatoria intestinal. En: Martínez Gómez MJ, Muñoz Codoceo RA, ed. Endoscopia digestiva pediátrica. Madrid: Ergon S.A.; 2010. p. 93-100.
14. Martínez Gómez MJ. Endoscopia digestiva alta en enfermedad inflamatoria intestinal. En: Martínez Gómez MJ, Muñoz Codoceo RA, ed. Endoscopia digestiva pediátrica. Madrid: Ergon S.A.; 2010. p. 91-93.
15. Hyams J, Crandall W, Kugathasan S, Griffiths A, Olson A, Johanns J, Liu G, Travers S, Heuschkel R, Markowitz J, Cohen S, Winter H, Veereman-Wauters G, Ferry G, Baldassano R; REACH Study Group. Induction and maintenance infliximab therapy for the treatment of moderate-to-severe Crohn’s disease in children. Gastroenterology. 2007; 132: 863-73.
16. Rosh JR, Lerer T, Markowitz J, Goli SR, Mamula P, Noe JD, Pfefferkorn MD, Kelleher KT, Griffiths AM, Kugathasan S, Keljo D, Oliva-Hemker M, Crandall W, Carvalho RS, Mack DR, Hyams JS. Retrospective Evaluation of the Safety and Effect of Adalimumab Therapy (RESEAT) in pediatric Crohn’s disease. Am J Gastroenterol. 2009; 104: 3042-49.
17. Medina E, Urruzuno P, Manzanares J. Tratamiento con nutrición enteral de la enfermedad de Crohn en el niño. Enf Inf Intest al día. 2007; 6: 105-110.
18. Hartman C, Berkowitz D, Weiss B, Shaoul R, Levine A, Adiv OE, Shapira R, Fradkin A, Wilschanski M, Tamir A, Shamir R Nutritional supplementation with polymeric diet enriched with transforming growth factor-beta 2 for children with Crohn’s disease. Isr Med Assoc J. 2008; 10: 503-7.
19. Thanaraj S, Hamlin J, Ford C. Systematic review: granulocyte/monocyte adsorptive apheresis for ulcerative colitis. Aliment Pharmacol Ther. 2010; 32: 1297-306.



No hay comentarios:
Publicar un comentario